Diagnostisches Vorgehen beim Cushing-Verdacht
Die Vielfältigkeit der Symptomatik, das Angebot an verschiedenen Untersuchungs- und Testverfahren sowie der im Einzelfall abzuwägende finanzielle Aufwand der Testung stellen die Tierärztin/den Tierarzt vor eine große Auswahl an Vorgehensmöglichkeiten beim Cushing-Verdacht. Im Folgenden werden die üblichen Untersuchungsverfahren im einzelnen aufgeführt und ihre Vor- und Nachteile insbesondere hinsichtlich der Testsicherheit sowie der Differenzierbarkeit nach adrenalem und hypophysärem Hyperkortizismus vergleichend dargestellt.
1. Klinisches Bild
So deutlich wie die klinischen Symptome des Hyperkortizismus in voller Ausprägung des klinischen Bildes sein können, so undeutlich – unspezifisch und spärlich - stellen sie sich im Anfangsstadium der Erkrankung dar.
1. Allgemein:
• Hund wirkt lustlos, schläft viel
• Hund hechelt vermehrt
• veränderte Läufigkeit
2. Haut:
• diffuser Haarverlust
• überlange, stumpfe, dünn wachsende und brüchige Haare
• Pigmentierungen der Haut
• dünne, trockene, empfindliche, leicht entzündliche Haut
• verzögerte Wundheilung nach Verletzungen
• erhöhte Anfälligkeit für bakterielle und dermatophytische Infektionen.
Erst nach klinischer Manifestation werden die vielfältigen Effekte auf den Intermediärstoffwechsel bedingt durch die chronische Hyperglukokortikoämie offensichtlich. Beim Hund zählt der endogene Hyperkortizismus zu den am häufigsten vorkommenden Endokrinopathien, gefolgt vom Pferd, während er bei der Katze nur sehr selten vorkommt. Bei Nutztieren scheint er nicht vorzukommen, was jedoch auf deren kurze Lebensdauer zurückzuführen sein dürfte (DÖCKE, 1994).
Formal-ätiologisch lassen sich der adrenale vom hypophysären Hyperkortizismus unterscheiden, in seltenen Fällen treten auch ektope Formen auf, weit häufiger iatrogene. Tabelle 1 gibt eine Übersicht über Ätiologie und prozentuale Verteilung der Formen des Hyperkortizismus bei Hund, Katze und Pferd (nach DÖCKE, 1994).
Tab. 1: Lokalisation und Verteilung der Formen des Hyperkortizismus
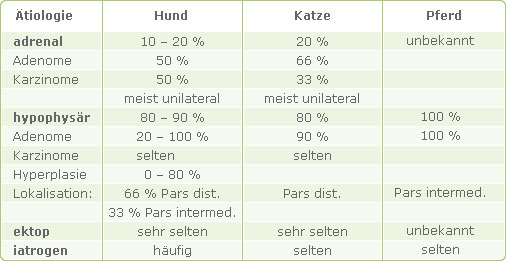
Die Diagnosestellung erfolgt beim Hund bezüglich des adrenalen Hyperkortizismus im Durchschnitt mit 10 bis 11 Jahren, bezüglich des hypophysären mit 7 bis 9 Jahren. Hündinnen sind dreimal häufiger betroffen als Rüden und Pudel, Teckel, Terrier, Beagle und Boxer häufiger als andere Hunderassen (FELDMANN, 1989).
Zu einem ektopen Hyperkortizismus kann es durch die vermehrte Bildung und Sekretion von ACTH durch Bronchialkarzinome sowie durch Karzinome des Thymus und des Pankreas kommen. Beim Menschen lassen sich etwa 15 % der ektopen Formen auf eine ektope ACTH- oder CRH-Sekretion zurückführen.
Das klinische Bild des Hyperkortizismus wird durch die Wirkung der über Monate und Jahre vermehrt sezernierten Glukokortikoide auf den Intermediärstoffwechsel bestimmt. In Tabelle 2 sind die für einen Cushing-Verdacht typischen Befunde sowie ihre Häufigkeiten zusammengestellt (nach DÖCKE, 1994).
Tab. 2: Häufigkeit des Vorkommens klinischer Symptome beim Hyperkortizismus (in %)
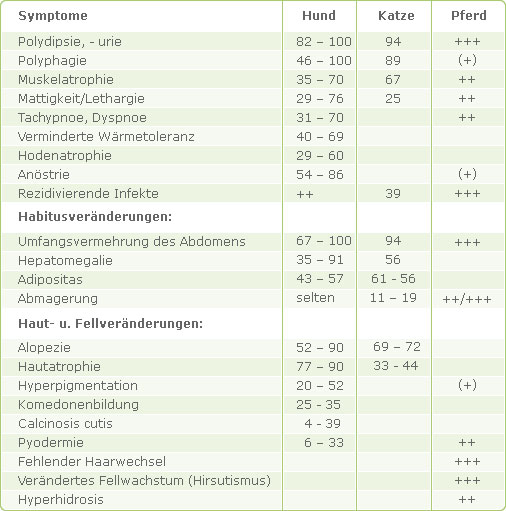
Nach SUTER (1997) begünstigen außerdem Hautatrophie und Immunsuppression schlecht heilende Hautwunden. Korneaulzera treten gehäuft auf und vielfach bestehen okkulte Harnwegsinfektionen mit symptomloser Struvitsteinbildung.
Labordiagnostisch fallen Blutbildveränderungen auf mit Eosinopenie durch Retention der Zellen im Knochenmark, absoluter Lymphopenie (< 1000/µl) bedingt durch einen beschleunigten Abbau, relativer Neutrophilie aufgrund einer verminderten Kapillardurchlässigkeit und der Stimulation des Knochenmarks, Erythrozyten- und Thrombozytenvermehrung als direkter Effekt der Glukokortikoide. Am auffälligsten ist die Erhöhung der Serumspiegel der alkalischen Phosphatase sowie der Leberenzyme ALT und GLDH, der Glukose und des Cholesterins. NNR-Tumoren können Hypernatriämie und Hypokaliämie bewirken. In bis zu 50 % der Fälle kann das Thyroxin im Serum erniedrigt sein.
2. Physiologische Aspekte
Die weit verbreitete Ansicht, dass ACTH- und Kortisolsekretion beim Hund einen zirkadianen Rhythmus aufweisen, beruht auf Untersuchungen von RIJNBERG et al. (1968), in denen nur 8 Blutproben pro Tag in Intervallen von 3 Stunden entnommen wurden. Neuere Untersuchungen an größeren Hundepopulationen mit ACTH- und Cortisolbestimmungen in Intervallen von 5 bis 30 Minuten haben gezeigt, dass Hunde eine episodische Sekretion von ACTH aufweisen, die zu großen Schwankungen der Kortisolkonzentration im Blut im Tagesverlauf führt. Deshalb besitzt die basale Plasmakonzentration von Kortisol keinen diagnostischen Wert. Tierindividuelle Variationen sind gegeben bezüglich der Kortisolpeaks (1 bis 17 pro Tag) und der ACTH-Peaks (6 bis 12 pro Tag) als auch hinsichtlich der Peakamplituden (JOHNSTON und MATHER, 1978; KEMPPAINEN und SARTIN, 1984; MIZOBUCHI et al., 1993). Daraus ergibt sich eine relativ große Spannbreite der im Blut zu messenden Kortisolkonzentration, und zwar sowohl beim klinisch gesunden als auch beim hyperkortisolämischen Hund.
Der Einfluss des Geschlechts auf Kortisol- und ACTH-Spiegel wird kontrovers angegeben. Während er in einigen Untersuchungen keinen Einfluss auf die Blutspiegel ausübte (JOHNSTON und MATHER, 1978), konnte in anderen festgestellt werden, dass die weiblichen Tiere höhere 24-Stunden-Durchschnittswerte hatten als die männlichen Tiere (KEMPPAINEN und SARTIN, 1984).
Die Autoren schließen unabhängig voneinander, dass der Zeitpunkt der Testung vor diesem physiologischen Hintergrund frei zu wählen und nicht an eine Periodizität gebunden ist.
Individuell liegen bei jedem Hund sehr unterschiedliche Kortisolbasalwerte vor. Ein physiologischer Kortisol-Basalwert liegt in der Regel zwischen 1.5 und 4.5 µg/dl Serum.
3. Möglichkeiten der Testung
Im Anfangsstadium eines Hyperkortizismus ist analog zum klinischen Bild nicht zu erwarten, dass bereits deutliche labordiagnostisch erfassbare hämatologische Befunde festzustellen sind. Einzig der Hyperkortizismus dürfte ermittelbar sein. Um einen solchen abzuklären sowie bei ausgeprägtem klinischem Bild die klinische Diagnose abzusichern, stehen für die Routinediagnostik folgende laborchemische Funktionstests zur Prüfung der Hypothalamus-Hypophysen-Nebennierenrinden-Achse zur Verfügung:
• Dexamethason-Screening-Test = Dexamethason-Low-Dose-Test
• ACTH-Stimulationstest
• Kombinierter Dexamethason/ACTH-Test
• Bestimmung des Kortisol-Kreatinin-Quotienten im Urin
• Dexamethason-Suppressionstest = Dexamethason-High-Dose-Test
• ACTH-Spiegelbestimmung
(Cave: Vom Testprinzip her betrachtet sind beide Dexamethason-Tests Suppressionstests, wobei das Ziel des niedriger dosierten die Sicherstellung des Hyperkortizismus ist und die des hochdosierten Tests die Differenzierung zwischen hypophysärem und adrenalem Hyperkortizismus.)
Beim Low-dose-Dexamethason-Screeningtest wird mit einer geringen Dosis Dexamethason (0.01 mg/kg KM) beim gesunden Hund innerhalb von 2 Stunden über einen Feedbackmechanismus die physiologische Kortisolausschüttung der NNR über einen Zeitraum von 24 bis 48 Stunden unterdrückt. Folglich können während der achtstündigen Testphase Blutkortisolwerte von < 1.0 µg/dl Serum gemessen werden.
Bei Hunden mit spontanem (hypophysärem oder NNR-) Cushing ist der Hemmeffekt von Dexamethason auf die Kortisolausschüttung der NNR 1. schwächer und 2. weniger lang anhaltend ausgeprägt. Außerdem können klinisch gestresste sowie chronisch kranke Hunde ein Ausbleiben des Hemmeffektes zeigen, ohne an einem Hyperkortizismus erkrankt zu sein! Nach PETERSON (1984) können während eines Low-dose-Dexamethason-Screeningtests unterschiedliche Reaktionsmuster bei Vorliegen eines Hyperkortizismus vorkommen. Dabei geht man davon aus, dass im Falle eines hypophysären Cushing zunächst der Feedbackmechanismus auf der Ebene der Hypophyse zustande kommt, so dass der 4-h-Wert erniedrigt, jedoch der 8-h-Wert wieder erhöht vorliegt, wohingegen eine hyperplastisch veränderte Nebenniere nicht über den Feedbackmechanismus reagiert, so dass 4- und 8-h-Wert erhöht sind. Nach KRAFT und DÜRR (1995) konnten in Einzelfällen auch Normalbefunde ermittelt werden, obwohl das klinische Bild eindeutig für einen Hyperkortizismus sprach.
Bei diesem Test handelt es sich um einen sehr häufig angewendeten diagnostischen Test, der durch eine Sensitivität von 85 – 95 % und eine Spezifität von 90 – 95 % gekennzeichnet ist (FELDMAN und NELSON, 1987; HERIPRET, 1995).
Die Aussagekraft dieses Tests liegt darin, einen Hyperkortizismus zu diagnostizieren. In manchen Fällen kann man darüber hinaus zwischen einem adrenalen und einem hypophysären Hyperkortizismus differenzieren.
Für den Dexamethason-low-dose-Test ergibt sich folgendes Reaktionsmuster für den Kortisolwert (vergleiche Tabelle 3):
 Tab. 3: Ergebnisse im Dexamethason-low-dose-Test Tab. 3: Ergebnisse im Dexamethason-low-dose-Test
Dem ACTH-Stimulationstest liegt das Testprinzip zugrunde, dass nach Applikation von 0.25 mg ACTH (Synacten®) i.v. nach 60 bis 90 Minuten die Kortisolkonzentration im Vergleich zum Basalwert vor der Applikation im Falle eines hypophysären Hyperkortizismus in 85 - 90 % der Fälle sowie in 50 % der Fälle von nebennierenbedingtem Hyperkortizismus auf mehr als das Dreifache ansteigt. Nur ein positives Ergebnis ist folglich ein sicheres Ergebnis, wohingegen im negativen Fall – kein übermäßiger Anstieg der Kortisolkonzentration - bei klinisch weiterhin bestehendem Cushing-Verdacht mit anderen Testverfahren fortgefahren werden muss. Der ACTH-Stimulationstest hat eine gute Spezifität von 85 – 100 % und Sensitivität von 67 – 80 % (FELDMAN und NELSON, 1987; HERIPRET, 1995), wobei letztere jedoch auf 56 % bei Nebennierentumoren fällt (PETERSON et al., 1982).
Der ACTH-Stimulationstest kann wie der Low-Dose-Dexamethason-Screeningtest eine Aussage darüber machen, ob ein Hyperkortizismus vorliegt oder nicht.
Mit dem kombinierten Dexamethason-ACTH-Test wird die Supprimierbarkeit und die Stimulierbarkeit der Nebenniere geprüft. Nach Entnahme einer Blutprobe zur Bestimmung des Kortisolbasiswertes wird 0.1 mg/kg Dexamethason i.v. verabreicht mit dem Ziel der Supprimierung der Nebenniere bzw. Hypophyse. Nach 2 Stunden wird eine 2. Blutprobe (= Suppressionswert) entnommen. Danach werden 0.25 mg ACTH (Synacten®) i.v. verabreicht und nach 60 Minuten eine 3. Blutprobe entnommen zur Bestimmung des Stimulationswertes. Die möglichen Ergebnisse werden in Tabelle 4 dargestellt:
 Tab. 4: deutliche Ergebnisse im Dexamethason-ACTH-Test Tab. 4: deutliche Ergebnisse im Dexamethason-ACTH-Test
Mithilfe dieses Tests ist es zwar möglich, mit einem Zeitaufwand von nur drei Stunden einen Hyperkortizismus festzustellen sowie u.U. auch einen hypophysären von einem nebennierenbedingten Cushing zu differenzieren, jedoch ist bei allen zeitlichen und einfach durchzuführenden Umständen unbedingt zu berücksichtigen, dass der Test mit großer Wahrscheinlichkeit mit Ungenauigkeiten und Interpretationsproblemen behaftet sein kann (FELDMANN, 1989). Aus diesem Grunde ist er zugunsten der Bestimmung des Kortisol-Kreatinin-Quotienten in den Hintergrund gedrängt worden (RIJNBERK et al., 1988; NICKEL, 1989).
Eine Alternative zu den aufgeführten Tests stellt die Bestimmung des Kortisol-Kreatinin-Quotienten im Harn dar.
Durch ein einmaliges Auffangen von Morgenurin und die Bestimmung der Kortisol- sowie der Kreatininkonzentration in der Harnprobe wird das Kortisol-Kreatinin-Verhältnis ermittelt (RIJNBERK et al., 1988; FELDMANN, 1994). Der physiologische Metabolit Kreatinin dient in diesem Test als relatives Maß für den physiologischen Parameter Kortisol. Beim Normalbefund ist der Kortisol-Kreatinin-Quotient < 11. Unter physiologisch erhöhtem Stoffwechsel ist zu erwarten, daß beide Metaboliten in höherer Konzentration vorliegen, so dass der Quotient unverändert (< 11) bleibt. Im Falle eines Hyperkortizismus steigt jedoch der Quotient proportional zum Kortisolgehalt an. Liegt er zwischen 11 und 16, handelt es sich um einen grenzwertigen Befund, so dass zur weiteren Abklärung ein Dexamethason-Low-Dose-Test oder ein ACTH-Test anzuschließen ist. Ist der Kortisol-Kreatinin-Quotient > 16, liegt ein positiver Befund vor.
Bei der Befundinterpretation ist zu beachten: Es können auch Hunde mit nicht hyperkortisol-assoziiertem Polydipsie-Polyurie-Syndrom stark erhöhte Kortisol-Kreatinin-Quotienten aufweisen (SOFFNER und REUSCH, 1996) sowie auch Hunde mit anderen non-adrenergen Erkrankungen (KAPLAN et al., 1995). Diese Tatsache mag u.a. erklären, warum ein positiver Befund nur mit einer Sicherheit von 80 % angegeben werden kann, d.h. es könnte sich zu 20 % um einen falsch positiven Befund handeln. Ein negativer Befund kann jedoch in jedem Fall als ein sicher negativer Befund gewertet werden.
Im positiven Fall wird zur weiteren Differenzierung ein Dexamethason-Low-Dose-Test durchgeführt, um den Hyperkortizismus abzusichern sowie ggf. abzuklären, ob es sich um eine hypophysäre oder um eine adrenerge Form handelt.
Die Methode der Bestimmung des Kortisol-Kreatinin-Quotienten im Harn ist ein sehr sensitiver Test (95 – 100 %), besitzt jedoch mit 25 % eine nur sehr geringe Spezifität (HERIPRET, 1995).)
Dieser Test empfiehlt sich als wenig aufwendige Testung zur ersten Abklärung eines möglicherweise bestehenden Hyperkortizismus.
In erweiterter Form kann dieser Test auch als Suppressionstest durchgeführt werden. Zu diesem Zweck wird außer am 1. Tag auch am 2. Tag morgens der Morgenurin aufgefangen. Außerdem wird im Abstand von 8 Stunden je 0.1 mg/kg KGW Dexamethason oral verabreicht. Am 3. Morgen wird eine dritte Probe Morgenurin aufgefangen. Beim gesunden Hund ist hier der Kortisolwert und folglich auch der Quotient erniedrigt, beim Hund mit Nebennierenadenom jedoch nicht und beim Hund mit hypophysärem Hyperkortizismus ist der Wert in ca. 50 % der Fälle erniedrigt.
Beim High-Dose-Dexamethason-Suppressionstest wird mit einer hohen Dosis Dexamethason (0.1 mg/kg KM) beim gesunden Hund wiederum innerhalb von 2 Stunden über einen Feedbackmechanismus die physiologische Kortisolausschüttung der NNR über einen Zeitraum von 24 bis 48 Stunden unterdrückt. Folglich können während der achtstündigen Testphase Blutkortisolwerte von < 1.0 µg/dl Serum gemessen werden.
Im Falle eines hypophysären Hyperkortizismus ist in 85 % der Fälle der Negativ-Feedback-Mechanismus nicht völlig aufgehoben, so dass ein Suppressionswert < 1.5 µg/dl als sicherer Befund für einen hypophysären Hyperkortizismus zu bewerten ist, ein Suppressionswert > 1.5 µg/dl ist als unsicherer Befund zu werten, da sich immerhin noch zu 15 % ein hypophysärer Hyperkortizismus dahinter verbergen kann.
Im Falle einer vollständigen Aufhebung des Feedback-Mechanismus ist ein ebenso sicherer Befund gegeben, und zwar dass ein nebennierenbedingter Tumor vorliegt. In seltenen Fällen kann es sich auch um einen ektopischen ACTH-produzierenden Tumor (Bronchial-, Thymus-, Pankreaskarzinom) handeln. Folglich ist dieser Test eine Möglichkeit zur Differenzierung von hypophysärem und nebennierenbedingtem Hyperkortizismus – aber nicht in jedem Fall mit 100 %iger Sicherheit.
Es ist bei der Befundinterpretation zu bedenken, dass etwa 15 % der Hunde mit hypophysärem Hyperkortizismus nach Dexamethasonapplikation nicht mit einer Suppression reagieren, was vom Ergebnis her fälschlicherweise als Nebennierenbefund verstanden werden könnte. Solche Fälle lassen sich damit erklären, dass die Neoplasien solcher Patienten vom Mittellappen der Hypophyse ausgehen. Da der Mittellappen jedoch gefässlos ist und von dopaminergen und serotonergen Fasern aus dem Hirn innerviert wird, reagiert diese Region relativ wenig bis gar nicht auf ACTH bzw. Dexamethason aus dem Blut.
ACTH-Spiegelbestimmung
Die ACTH-Blutspiegelbestimmung ist ein sehr zuverlässiger Test, um NNR-Tumoren, welche die ACTH-Sekretion unterdrücken, von dienzephal-hypophysären Tumoren zu differenzieren, da letztere den ACTH-Spiegel erhöhen. Schwierig ist jedoch die Handhabung, da diese Bestimmungen in Plastikröhrchen aufgefangenes EDTA-Blut erfordern, das sofort zentrifugiert und bei –20 °C in Kühlgefäßen versandt werden muß.
Die ACTH-Blutspiegelbestimmung dient der Abgrenzung eines dienzephal-hypophysären von einem adrenergen Hyperkortizismus.
4. Aussagekraft der einzelnen Tests
Aufgrund der Testprinzipien sowie aufgrund der biologisch gegebenen vielfältigen Reaktionsmöglichkeiten des zu untersuchenden Probanden muss die Auswahl eines oder mehrerer Testverfahren nach Aussage- und Differenzierungsmöglichkeit sowie der Testsicherheit abgewogen werden. In Tabelle 5 wird diesbezüglich eine Übersicht gegeben:
 Tab. 5: Anwendungsbereich und Sicherheit der einzelnen Tests Tab. 5: Anwendungsbereich und Sicherheit der einzelnen Tests
5. Aufwand und Kosten
Unter Berücksichtigung der Art der Probengewinnung, des zeitlichen und finanziellen Aufwandes der einzelnen Tests ergibt sich folgende Übersicht (vgl. Tabelle 6).
Die zeitlich und finanziell günstigste Methode zur ersten Eruierung eines Hyperkortizismus kann mit der Bestimmung des Kortisol-Kreatinin-Quotienten aus dem Harn durchgeführt werden. Erst wenn hier ein positiver Befund vorliegt, stehen für die weitere Diagnostik auch weitere Kosten an.
Eine zeitlich und finanziell aufwendigere Methode besteht im Dexamethason-Low-Dose-Test, der im günstigsten Fall den Hyperkortizismus absichert und eine Differenzierung zwischen hypophysärer und adrenerger Form erlaubt. Dieser Test ist in der ambulanten Sprechstunde durchführbar, bedeutet jedoch für den Tierbesitzer ein genaues Einhalten der Probenentnahmezeiten und einen dreimaligen Tierarztbesuch für den Hund oder eine längere Verweildauer des Hundes über den Tag in der Praxis/Klinik. Dabei ist zu berücksichtigen, daß sich der Hund dabei sicherlich in einer Stresssituation befindet, die die Cortisolwerte beeinflussen kann.
 Tab. 6: Aufwand der Testung Tab. 6: Aufwand der Testung
Eine zeitlich und finanziell sehr aufwendige, letztlich aber auch sehr exakte Methode ist die von KRAFT und DÜRR (1995) beschriebene, wonach der Hund einen Tag vor der Testung klinisch eingestellt wird, um sich an die Kliniksituation zu gewöhnen. Am darauffolgenden Tag wird ein ACTH-Test durchgeführt zur Eruierung des Hyperkortizismus. An einem dritten Klinikaufenthaltstag wird der Dexamethason-Low-Dose-Test durchgeführt zur Differenzierung des Hyperkortizismus.
Letztendlich haben die einzelne Tierärztin und der einzelne Tierarzt abzuwägen, in welchem Fall mit welchem Aufwand, bei welchem Patientenbesitzer am besten vorzugehen ist. Die dargestellten Übersichten und Zusammenfassungen stellen eine Entscheidungshilfe für die Auswahl aller zur Zeit gegebenen Testmöglichkeiten dar.
In der Praxis haben sich in Abhängigkeit von sachlich-fachlichen, finanziellen und zeitlichen Überlegungen folgende Vorgehensweisen durchgesetzt:
1. Im Falle eines unklaren klinischen Bildes:
Bestimmung des Kortisol-Kreatinin-Quotienten im Morgenurin
Diese Methode ist leicht durchführbar, kostengünstig und bedingt wenig Aufwand. Nur im positiven Fall entstehen weitere Kosten. Fürs erste ergibt sich ein Aufwand für Laborkosten von ca. € 35;.
2. Im Falle einer ohnehin anstehenden Blutuntersuchung unter
Praxisbedingungen:
Dexamethason-Screeningtest = Dexamethason-Low-Dose-Test
Dieser Test ist der bevorzugte Test, da ein Hyperkortizismus abgeklärt und eine Differenzierung zwischen adrenerger und dienzephal-hypophysärer Form u.U. durchgeführt werden kann. Der Test ist allerdings zeitaufwendig, da entweder der Hund über die achtstündige Testdauer eingestellt oder der Besitzer am Testtag dreimal in die Praxis kommen muß. Es entsteht ein Kostenaufwand von ca. € 55 bzw. € 75
3. Alternativ zum 2. Fall könnte zur Vermeidung des zeitlichen Aufwandes auch ein ACTH-Stimulations-Test durchgeführt werden.
Der Test bietet den Vorteil, dass er nach 90 Minuten abgeschlossen ist. Nachteilig ist die Anwendung von ACTH insoweit, als das Mittel teurer ist als Dexamethason und die Haltbarkeit von ACTH ist nur kurz. Es entsteht ein Kostenaufwand für die Laborkosten von ca. € 55.
4. Für eine sichere Testung eines Cushingverdachtes bedarf es nach der Methode von KRAFT und DÜRR (1995) zusätzlich zum ACTH- (€ ca. 55) und Dexamethason-Screening-Test (€ 55 bzw. € 75) eines dreitägigen Aufenthaltes des Hundes, der je nach Hundegröße mit mindestens € 16 bis € 48 pro Hund pro Tag, also weiteren 48 bis 144 € in Rechnung zu bringen ist. Nicht berücksichtigt wurden bei den Preisangaben die Honorargebühren für Untersuchungen, Blutentnahmen, Test-Arzneimittel wie Dexamethason und ACTH sowie Probenbearbeitungen und Versandkosten.
6. Literatur
DÖCKE, F. (1994)
Veterinärmedizinische Endokrinologie, 3. Aufl.
Gustav Fischer Verlag Jena und Stuttgart
FELDMANN, E.C. (1989): Adrenal gland disease. In: ETTINGER, S.J. (hrsg.): Textbook of veterinary internal Medicine. 3. Aufl., W.B. Saunders, Philadelphia, 1721 - 1774
FELDMAN, E.C, und R.W. NELSON (1987): Hyperadrenocorticism. In: Canine and feline endocrinology and reproduction. W.B. Saunders, Philadelphia
HERIPRET, D. (1995): Etude des différents tests diagnostiques de l‘ hypercorticisme spontané du chien. Pratique Médicale et Chirurgicale de l ‚Animal de Compagnie 30: 309 - 317
JOHNSTON, S.D., und E.C.MATHER (1978): Canine Plasma Cortisol (Hydrocortisone) Measured by Radioimmunoassay: Clinical Absence of Diurnal Variation and Results of ACTH Stimulation and Dexamethasone Suppression Tests. Am. J. Vet. Res. 39: 17661770
KAPLAN, A.J., M.E. PETERSON und R.J. KEMPPAINEN (1995): Effects of disease on the results of diagnostic tests for use in detecting hyperadrenocorticism in dogs. J. of the Am. Vet. Med. Ass. 207: 445 - 451
KEMPPAINEN, R.J., und J.L. SARTIN (1984): Evidence of episodic but not circadian activity in plasma concentrations of adrenocorticotrophin, cortisol and thyroxine in dogs, J. Endocr. 103: 219 – 226.
KRAFT, W., und U. DÜRR (1995): Klinische Labordiagnostik in der Tiermedizin. (3. Aufl.), Schattauer Verlag
MIZOBUCHI, M., T. HINENO, Y. KAKIMOTO und K. HIRATANI (1993): Increase of plasma adrenocorticotrophin and cortisol in 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)-treated dogs. Brain Research 612: 319 – 321.
NICKEL, R. (1990): Zur Diagnostik und Therapie beim Cushing-Syndrom des Hundes. Kleintierpraxis 35: 224 - 234
PETERSON, M.E., S.R. GILBERTSON und W.D. DRUCKER (1982): Plasma cortisol response to exogenous ACTH in 22 dogs with hyperadrenocorticism caused by adrenocortical neoplasia. J. of the Am. Vet Med. Association 180: 542 – 544.
PETERSON, M.E., Hyperadrenocorticism. Vet. Clin. North Am. – Small Anim. Pract.14:
731 - 741
RIJNBERK, A., P.J. der KINDEREN und J.H.H. THIJSSEN (1968): Investigations on the adrenocortical function of normal dogs. J. of. Endocr. 41: 387 – 395.
RIJNBERK, A., A. VAN WEES und J.A. MOL (1988): Assessment of two tests for the diagnosis of Canine Hyperadrenocorticism. Vet. Rec.122: 178 – 180.
SOFFNER, C., und C. REUSCH (1996): Untersuchungen zur Aussagekraft des Kortisol-Kreatinin-Verhältnisses im Urin (UC/C) für die Diagnose des caninen Hyperadrenocortizismus. Kleintierpraxis 41: 85 – 96).
|



